
Sarcoidosi oculare
a cura di Fabiana Viscogliosi e Luca Cimino
La sarcoidosi è una malattia sistemica cronica, granulomatosa, ad eziologia sconosciuta. La prevalenza è di 20-50 casi su 100.000 nella popolazione caucasica e le etnie più colpite sono i Neri d’America e gli Scandinavi/Irlandesi. In Italia è una patologia rara, rappresentando il 4-8% del totale delle uveiti1. La fascia d’età maggiormente interessata è compresa tra i 20 e 40 anni, con una leggera prevalenza del sesso femminile (1,5: 1). 2 La patologia é caratterizzata istologicamente dalla presenza di granulomi epitelioidi e gigantocellulari in assenza di necrosi caseosa 3,4. Attualmente si ritiene che la Sarcoidosi rappresenti una risposta abnorme del sistema immunitario verso uno o più antigeni in soggetti con alterazioni del sistema immunitario sia di tipo ereditario che acquisito5. Gli organi più comunemente colpiti sono i polmoni, i linfonodi, la cute, l’occhio, il sistema nervoso, il fegato e le articolazioni. Le manifestazioni oculari sono polimorfe e possono variare da una semplice uveite anteriore ad una panuveite bilaterale severa. Non esiste un’unica diagnosi di sarcoidosi, poichè questa patologia si basa su criteri clinici, radiologici, biologici ed istologici 6,7. L‘occhio è colpito nel 25-50% dei pazienti ed il 25-60% dei pazienti che presenta una forma sistemica può sviluppare un interessamento oculare che si manifesta per lo più entro i primi 2 anni dall’esordio della malattia. La malattia può interessare gli annessi con granulomi della palpebra o della ghiandola lacrimale, l’orbita con granulomi dell’orbita o dei muscoli, la congiuntiva con granulomi congiuntivali, la sclera con episcleriti, scleriti nodulari o diffuse oppure, come avviene nella maggior parte dei casi, interessare l’uvea.
L’uveite anteriore
nelle forme tipiche si presenta in forma cronica, granulomatosa, uni o bilaterale, con precipitati retro-cheratici a grasso di montone (Fig.1), noduli iridei di Koeppe o Busacca, noduli sul trabecolato, tyndall della camera anteriore, sinechie irido-lenticolari e periferiche anteriori ed ipertono oculare.

Fig. 1: sarcoidosi oculare
1 - uveite anteriore granulomatosa + sinechie posteriori (fase acuta)
2 - fase di convalescenza (stesso caso).
L’uveite intermedia
si manifesta con vitreite più o meno intensa che può associarsi alla presenza di opacità ad aspetto di ”collana di perle”, periflebiti segmentarie e focali periferiche. L’evoluzione dell’uveite intermedia è spesso positiva con la persistenza di lieve tyndall vitreale ed addensamenti periferici del vitreo; le vasculiti cicatrizzano sotto forma di restringimenti vascolari, localizzati circondati da un manicotto bianco, secco.
L’uveite posteriore,
si può presentare con vitreite di intensità variabile, periflebite venosa segmentaria e focale per lo più non occlusiva al polo posteriore e soprattutto in media periferia associata ad emorragie intraretiniche, inguainamento vascolare arterioso, essudati perivenosi detti “a goccia di cera” (Fig. 2), granulomi coroideali (Fig. 4 a,b,c), edema maculare, papillite, papilledema e granulomi del nervo ottico.

Fig. 2: Sarcoidosi oculare
a) Grosso essudato perivenoso a “goccia di cera” (ø circa 4 DO) e
b), c) e d) fase di progressiva risoluzione dopo terapia.
La diagnosi di sarcoidosi può essere semplice se la malattia ha un esordio acuto e generalizzato con segni caratteristici oppure più difficile se l’esordio è subdolo, con interessamento oculare più o meno caratteristico, ma con localizzazioni extra-oftalmologiche assenti o atipiche. In questo contesto la biopsia dei tessuti coinvolti risulta dirimente nell’impostazione della giusta terapia. Elementi di supporto alla diagnosi possono derivare dalla diagnostica polmonare con Rx o TAC ad alta risoluzione del torace (HRCT), lavaggio bronco-alveolare (BAL) con evidenza di alveolite linfocitaria, aumentato rapporto CD4/CD8, scintigrafia con 67-Gallio, biopsia endo-transbrochiale o mediastinica e segni dermatologici come lupus pernio, eritema nodoso, noduli sottocutanei. Molto importante è l’impiego della TAC del torace (Fig. 3) a strato sottile(HRTC) che offre una migliore risoluzione nell’identificare i linfonodi anche quando la radiografia del torace è negativa e la biopsia linfonodale mediastinica che consente una garanzia di conferma diagnostica per la sarcoidosi.
Anche il profilo biochimico può aiutare nella diagnosi, grazie all’aumento di ACE, lisozima o beta 2 globulina. Frequentemente si associa un bilancio fosfo-calcio anormale con ipercalcemia ed ipercalciuria; possono essere altresì presenti anergia cutanea e attivazione policlonale dei linfociti B 8.

Fig.3: Linfoadenopatia mediastinica (freccia gialla) evidente con Tac ad alta risoluzione in 2 pazienti con sarcoidosi: comparazione con radiografia del torace negativa (negli stessi 2 pazienti).
Nel 2006 sono stati stabiliti i Criteri Internazionali per la Diagnosi di sarcoidosi oculare (Consensus Conference, Tokio)9. In particolare sono stati individuati sette segni diagnostici di sarcoidosi oculare: 1) cherato-precipitati a grasso di montone, piccoli cherato-precipitati granulomatosi e/o noduli iridei (koeppe/Busacca), 2) noduli del trabecolato e/o sinechie periferiche anteriori a forma di tenda, 3) opacità del vitreo “a palla di neve”, o “a collana di perle”, 4) lesioni multiple corioretiniche periferiche (attive e/o atrofiche), 5) peri-flebiti nodulari e/o segmentarie ( +/- a goccia di cera) e/o macroaneurismi in un occhio infiammato, 6) noduli/granulomi del nervo ottico e/o noduli solitari coroideali e 7) bilateralità.
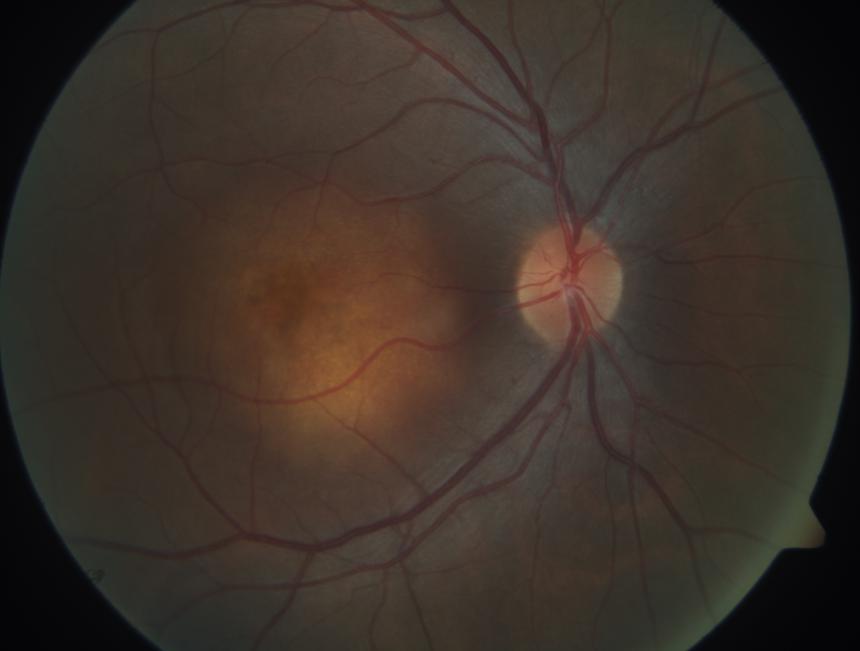
Fig. 4: a) granuloma corioretinico maculare in sarcoidosi.
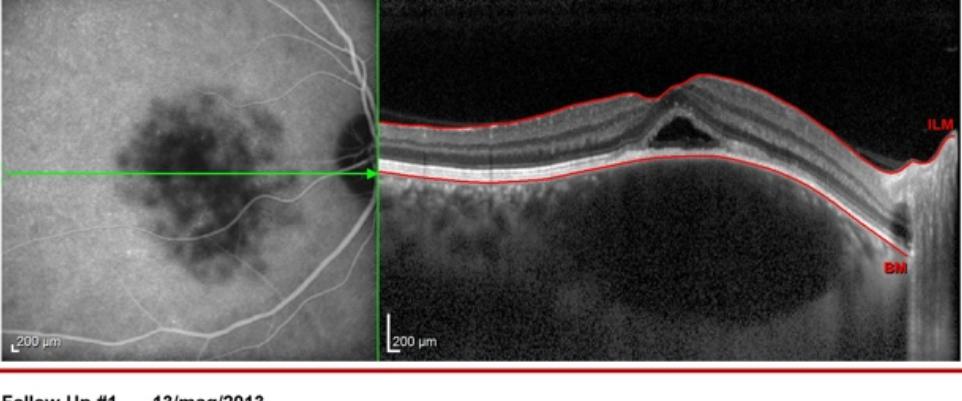
Fig. 4: Granuloma corioretinico maculare in sarcoidosi. b) ICG: ipofluorescenza maculare e c) OCT-EDI.
Sono stati poi individuati i test di laboratorio e le procedure di indagine che forniscono supporto alla diagnosi di sarcoidosi oculare nei pazienti che presentano i segni oculari sopra citati: 1) test cutaneo per TBC negativo in pazienti vaccinati con BCG o con test per TBC precedentemente positivo, 2) elevati livelli sierici di ACE e lisozima, 3)Rx torace con linfoadenopatia ilare bilaterale, 4) elevati livelli degli enzimi epatici (ALP, AST, ALT) , 5) TAC polmonare positiva in pazienti con RX torace negativo. Sono state poi distinte quattro categorie di certezza diagnostica per la sarcoidosi oculare: 1) definita = diagnosi supportata dalla biopsia con uveite compatibile, 2) presunta = se biopsia non eseguita, ma Rx torace positiva per linfoadenopatia ilare bilaterale associata ad uveite compatibile, 3) probabile = se biopsia non eseguita, Rx torace negativa per linfoadenopatia ilare bilaterale, ma presenza di 3 segni oculari e di 2 test di laboratorio positivi, 4) possibile = se biopsia polmonare negativa, ma presenza di almeno 4 segni oculari e di 2 test di laboratorio positivi.
La terapia per la sarcoidosi dipende dalla sede e dal grado di interessamento degli organi (9,10). A livello locale vengono usati i corticosteroidi topici e/o perioculari in associazione a midriatici e cicloplegici. La terapia sistemica prevede l’uso di corticosteroidi e viene instaurata in caso di localizzazione a carico dell’occhio, del SNC, del polmone o del cuore. Il dosaggio di corticosteroidi dipende dalla severità della patologia a carico dei vari organi. Generalmente si utilizza prednisone alla dose di 0,5–1 mg/kg/die per un periodo variabile da 2 a 3 mesi per poi scalare progressivamente fino alla dose minima efficace. I boli di metilprednisolone possono essere efficaci nelle forme che minacciano l’acuità visiva a breve termine e le dosi utilizzate possono variare da 500 mg a 1 g/die per tre giorni. In caso di terapia steroidea prolungata e quando la dose non può essere ridotta al di sotto di una soglia accettabile o, in presenza di controindicazioni, è necessario ricorrere a immunosoppressori. Il più utilizzato è il metotrexate a basso dosaggio, sotto sorveglianza del bilancio epatico, oppure l’azatioprina, mentre la ciclosporina, usata in passato nel trattamento dell’uveite, ora non è più impiegata a causa dei numerosi effetti collaterali e per l’efficacia controversa negli altri organi. I farmaci biologici anti-TNF sono efficaci in caso di fallimento dei trattamenti precedenti, ma possono riattivare una tubercolosi quiescente.
BIBLIOGRAFIA:
1. Cimino L, Aldigeri R, Salvarani C, Zotti CA, Boiardi L, Parmeggiani M, Casali B, Cappuccini L. The causes of uveitis in a referral centre of Northern Italy.Int Ophthalmol. 2010 Oct;30(5):521-9.
2. Rothova A, Buitenhuis HJ, Meenken C, et al. Uveitis and systemic disease. Br J Ophthalmol 1992:76:137-41
3. Jones NP. Sarcoidosis and Uveitis. Ophthalmol Clin North Am 2002; 15: 319-26
4. Cowan Jr CL. Sarcoidosis. In : Yanoff. Ophthalmology. Mosby Inc. 2004; 175:1185-90
5. Jones NP. Sarcoidosis and granulomatous diseases. In: Uveitis an illustrated manual. Butterworth Einemann 2001; 16:265-80
6. James DG. Ocular Sarcoidosis. Ann NY Acad Sci 1986; 465:551-63
7. James DG, Neville E, Langley DA. Ocular Sarcoidosis. Trans Ophthalmol Soc UK 1976; 96: 133-9
8. Kawaguchi T, Hanada A, Horie S, et al. Evaluation of characteristic ocular signs and systemic investigations in ocular Sarcoidosis. Jap J Ophthalmol 2007; 51: 121-6
9. Herbort CP, Rao NA, Mochizuki M; members of Scientific Committee of First International Workshop on Ocular Sarcoidosis. International criteria for the diagnosis of ocular sarcoidosis: results of the first international workshop on ocular sarcoidosis (IWOS). Ocul Immunol Inflamm 2009; 17 (3):160-9
10. Nussenblatt RB, Palestine AG. Uveitis: fundamentals and clinical practice. Chicago Year Book, 1989; 198-211
11. Palestine AG, Nussenblatt RB, Chan CC. Treatment of intraocular complications of Sarcoidosis. Ann NY Acad Med 1986; 465:564-73
